Conteúdos
Este roteiro de estudos de química aborda conceitos fundamentais envolvidos no balanceamento de equações químicas, com uma breve introdução à Lei de Lavoisier. Apresenta a estrutura padrão de uma equação química e um método específico para se efetuar o balanceamento de tais equações (método por tentativa), a partir de alguns exemplos. O material também conta com algumas sugestões de vídeos (possibilitando uma ampliação e aprofundamento em determinados tópicos), encerrando com a resolução comentada de exercícios de vestibulares.
● Introdução – Lei de Lavoisier;
● Estrutura de uma equação química;
● Balanceamento de equações químicas.
Objetivos
● Compreender a Lei de Conservação das Massas;
● Compreender qual é a estrutura de uma equação química; e
● Aprender a fazer o balanceamento de equações químicas.
Palavras-chave:
Lei de Lavoisier. Lei de Conservação das Massas. Balanceamento de equações químicas. Método por tentativa.
Proposta de trabalho:
O objetivo deste roteiro é auxiliar nos estudos em casa ou em outro ambiente. Nesse sentido, apresenta um percurso com textos-base e algumas propostas de atividades. No final, há outros textos e vídeos que podem ajudar a compreender melhor o tema em questão.
Não é necessário fazer todas as etapas, ler todos os textos, ou assistir todos os vídeos, mas as questões norteadoras, bem como as subquestões que advêm delas, ajudam na captação do conteúdo inteiro e dos principais conceitos.
Leia os textos propostos, sempre buscando as respostas para cada uma das perguntas. Se aparecerem mais dúvidas ao longo da leitura, aproveite para fazer anotações em seu caderno e ampliar ainda mais sua pesquisa. Após as leituras de cada um dos textos, escreva um parágrafo resumindo seu aprendizado.
1ª Etapa: Introdução – Lei de Lavoisier

Uma das leis mais importantes para o estudo da química é a Lei de Conservação das Massas, também conhecida como Lei de Lavoisier, que diz o seguinte:
“Na natureza, nada se cria, nada se perde, tudo se transforma.”
Antoine Laurent de Lavoisier (1743-1794) foi um importante cientista francês que, devido a suas grandes contribuições científicas, é considerado o “pai” da Química Moderna.
A Lei de Lavoisier também pode ser expressa da seguinte forma:
“Em um recipiente fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos.”
Isso significa que, quando estamos trabalhando com uma equação química, o número de átomos nos reagentes precisa ser igual ao número de átomos nos produtos.
Para saber mais, assista:
Lei de Lavoisier ∣Leis ponderais – Brasil Escola
Acesso em: 7 de julho de 2021.
2ª Etapa: Estrutura de uma equação química
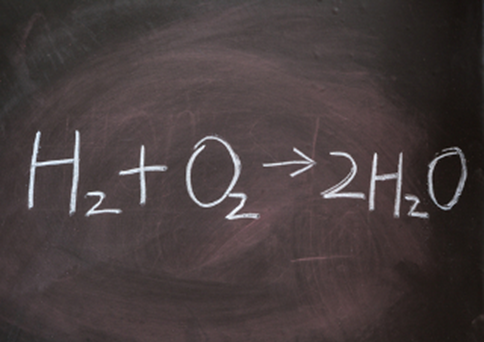
Seja na natureza ou em laboratório, existem diversos processos de reações químicas que podem ocorrer. A forma que utilizamos para representar/descrever tais reações são as equações químicas. Podemos dizer então:
“A equação química expõe, de forma quantitativa e qualitativa, os processos envolvidos numa reação química.”
Numa equação química, por convenção, do lado esquerdo nós sempre teremos os reagentes, e do lado direito, os produtos. Ou seja:
Reagentes→ Produtos
A seta (→) representa a reação química que está sendo descrita.
Existem outros símbolos que podem ser utilizados na descrição de uma reação química. São eles:

De forma genérica, podemos representar uma equação química da seguinte maneira:
aA+bB→cC+dD
Onde as letras maiúsculas:
A e B = Representam as moléculas dos reagentes;
C e D = Representam as moléculas dos produtos.
E as letras minúsculas:
a e b =São os coeficientes estequiométricos das moléculas dos reagentes;
c e d =São os coeficientes estequiométricos das moléculas dos produtos.
O número de átomos de cada elemento químico que compõe as moléculas é indicado pelo índice, ou seja, pelo número subscrito, que fica na parte direita inferior do elemento químico em questão. Quando esse número é um, o subscrito não precisa ser evidenciado.
Não podemos alterar os subscritos dos elementos químicos, pois estaríamos modificando o tipo de molécula envolvida na reação química.
Em uma equação química não balanceada, ou seja, em que o número de átomos dos reagentes é diferente do número de átomos dos produtos, são os coeficientes estequiométricos (a, b, c e d) que devem ser manipulados, até que o lado esquerdo e direito estejam iguais, ou seja, balanceados. Os coeficientes estequiométricos são os números que aparecem antes das moléculas, indicando a quantidade de cada componente na reação química. Quando o coeficiente estequiométrico é igual a 1 (um), ele não aparece.
A partir do que foi discutido até o momento, responda às perguntas abaixo.
Analisando a equação química a seguir, identifique o que se pede:
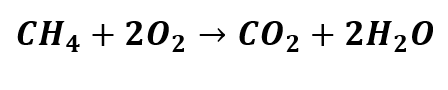
– Quais são as moléculas dos reagentes?
– Quais são as moléculas dos produtos?
– Quais são os coeficientes estequiométricos dos reagentes?
– Quais são os coeficientes estequiométricos dos produtos?
– O número de átomos dos reagentes é igual ao número de átomos dos produtos? Ou seja, a equação química está balanceada?
Para saber mais, assista:
Equações químicas – O que representa a equação química? – EscolAnimada
Acesso em: 7 de julho de 2021.
3ª Etapa: Balanceamento de equações químicas
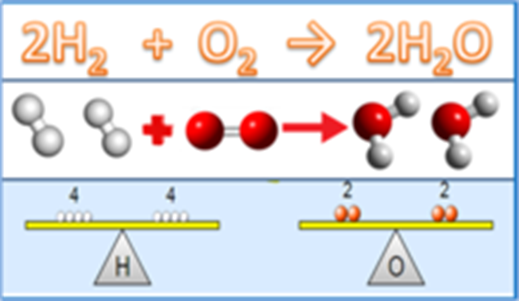
Agora que já temos conhecimento da Lei de Conservação das Massas e sabemos como é a estrutura de uma equação química, bem como as regras que ela deve obedecer para que esteja correta, vamos trabalhar com algumas equações químicas não balanceadas, visando o seu balanceamento.
Existem alguns métodos que são utilizados para efetuar o balanceamento de uma equação química. Dentre eles, podemos citar:
• Método por tentativa;
• Método da oxirredução; e
• Método algébrico.
Neste roteiro de estudos, vamos nos concentrar no primeiro, o método por tentativa.
Tal método consiste em manipular os coeficientes das componentes da equação química, até balanceá-la. Contudo, existe uma regra básica, que pode nos guiar durante a aplicação do método.
Conhecida pela sigla “MACHO”, essa regra indica por qual tipo de elemento químico devemos começar a manipulação dos coeficientes. O significado de cada letra da sigla é:

É indicado observar qual é o elemento que possui o maior número de átomos (maior atomicidade) na equação química, e começar por ele.
Exemplo 01 – Vejamos a seguinte equação química:
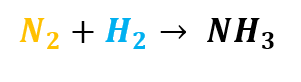
i) Primeiramente, vamos identificar quais são os elementos químicos envolvidos, e conferir se tal equação química está balanceada:

Percebe-se que o número de átomos dos elementos químicos Nitrogênio e Hidrogênio nos reagentes é diferente do número de átomos desses elementos no produto. Ou seja:
- nº de átomos de N nos reagentes≠nº de átomos de N no produto
- nº de átomos de H nos reagentes≠nº de átomos de H no produto
Portanto, a equação química não está balanceada.
ii) Observando a regra do “MACHO”, devemos começar manipulando o coeficiente do elemento químico Nitrogênio (N), pois ele é um ametal. Como nos reagentes existem dois átomos de N, vamos colocar o número dois na frente do Nitrogênio no produto. Ou seja, vamos trocar o coeficiente estequiométrico do produto de um para dois.
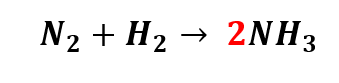
Ao efetuarmos essa troca de coeficiente no produto, alteramos o número de átomos de Hidrogênio (H) também. Agora, temos seis átomos de Hidrogênio no produto, e apenas 2 dois átomos de H nos reagentes. Como 3.2=6, podemos colocar o número três na frente do H nos reagentes, da seguinte forma:
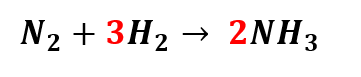
Vejamos agora o número de átomos de cada elemento químico, Nitrogênio e Hidrogênio, nos reagentes e no produto.

Ou seja, agora a equação está balanceada.
Portanto, a forma correta de representar a equação química é:
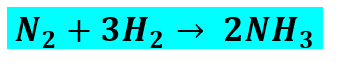
Exemplo 02 – Analisemos agora esta outra equação química:
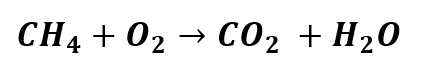
i) Primeiramente, vamos identificar quais são os elementos químicos envolvidos, e conferir se tal equação química está balanceada:
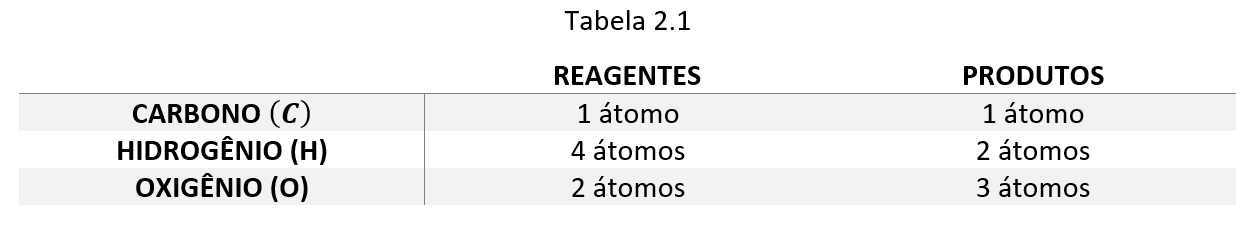
Assim sendo:
- nº de átomos de C nos reagentes=nº de átomos de C no produto
- nº de átomos de H nos reagentes≠nº de átomos de H no produto
- nº de átomos de O nos reagentes≠nº de átomos de O no produto
Embora o número de átomos de Carbono (C) seja igual nos reagentes e nos produtos, o número de átomos de Hidrogênio (H) e Oxigênio (O) diferem. Portanto, a equação química não está balanceada.
ii) Novamente, observando a regra do “MACHO”, devemos começar manipulando o coeficiente do elemento químico Hidrogênio (H), pois ele aparece primeiro na sigla (“MACHO”). Mudando o coeficiente do H de um para dois nos produtos, temos:
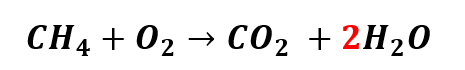
Agora, temos quatro átomos de Oxigênio (O) nos produtos. Para que o número de átomos de O nos reagentes seja igual, devemos trocar o coeficiente do Oxigênio de um para dois, da seguinte forma:
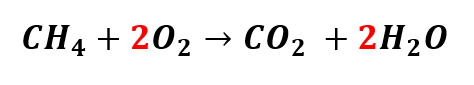
Vejamos agora o número de átomos de cada elemento químico, Carbono (C), Hidrogênio (H) e Oxigênio (O), nos reagentes e nos produtos.

O que significa que a equação química está finalmente balanceada. E a forma correta de escrevê-la é:
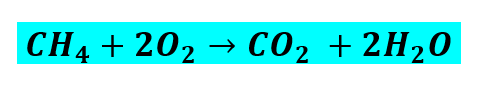
Para saber mais, assista:
Balanceamento de equações químicas – Brasil Escola
Acesso em: 8 de julho de 2021
Balanceamento de equações por tentativa – Brasil Escola
Acesso em: 8 de julho de 2021
Balanceamento de equações químicas – Professora Sabrina Química
Acesso em: 8 de julho de 2021
4ª Etapa: Cheque seus conhecimentos
Resolver questões de vestibular e do ENEM é um excelente exercício durante o estudo autodirigido. Isso porque essas questões são seguidas de gabarito, mesmo quando são dissertativas. Abaixo, alguns exemplos de questões sobre o tema estudado:
1) (UEPA) Considerando-se a equação química não balanceada
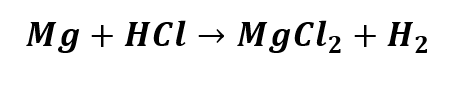
e admitindo-se, num balanceamento, o coeficiente 6 (seis) para cada produto, o coeficiente de cada reagente será, respectivamente:
a) 3 e 6.
b) 6 e 6.
c) 6 e 12.
d) 12 e 6.
e) 12 e 12.
Resposta: C.
Resolução:
Colocando o coeficiente 6 nos produtos, ficamos com:
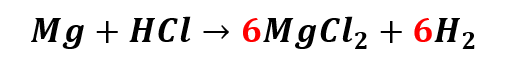
Temos seis átomos de Magnésio (Mg), então esse será seu coeficiente no reagente:
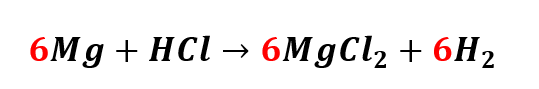
Portanto, o coeficiente de cada reagente é, respectivamente, 6 e 12.
(Disponível em: Brasil Escola. Acesso em: 28 de junho de 2021).
2) (Mackenzie-SP)
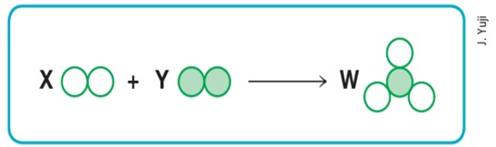
Supondo que os círculos vazios e cheios, respectivamente, signifiquem átomos diferentes, então o esquema anterior representará uma reação química balanceada se substituirmos as letras X, Y e W, respectivamente, pelos valores:
a) 1, 2 e 3.
b) 1, 2 e 2.
c) 2, 1 e 3.
d) 3, 1 e 2.
e) 3, 2 e 2.
Resposta: D.
Resolução:
1º passo: Atribuímos letras para facilitar a compreensão da equação.
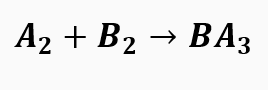
2º passo: Somamos os índices para saber quem tem maior número de átomos na equação.

A e B aparecem apenas uma vez em cada membro da equação. Porém, se somarmos os índices observamos que A tem o maior valor. Por isso, iniciamos o balanceamento por ele.
3º passo: Balanceamos o elemento A transpondo os índices e transformando-os em coeficientes.
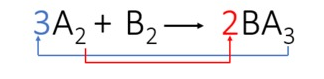
Observamos que automaticamente o elemento B foi balanceado e os coeficientes da equação são: 3, 1 e 2.
(Disponível em: Toda Matéria. Acesso em: 28 de junho de 2021).
3) O peróxido de hidrogênio é um composto químico que pode se decompor, formando água e oxigênio, conforme a equação química a seguir.
A respeito dessa reação a equação corretamente balanceada é:
a) H2O2 → O2 + H2O
b) 2H2O2 → O2 + 2H2O
c) H2O2 → 2O2 + H2O
d) 2H2O2 → 2O2 + 2H2O
Resposta: B.
Resolução:
Observe que o peróxido de hidrogênio é uma substância química formada por átomos de dois elementos químicos: hidrogênio e oxigênio.
Após a reação de decomposição, deve-se ter o mesmo número de átomos dos dois elementos, tanto nos reagentes quanto nos produtos. Para isso, precisamos efetuar o balanceamento da equação.
Observe que temos 2 átomos de hidrogênio no reagente (H2O2) e dois átomos no produto (H2O). Entretanto, o oxigênio apresenta dois átomos no reagente (H2O2) e três átomos nos produtos (H2O e O2).
Se colocarmos o coeficiente 2 antes do peróxido de hidrogênio, dobramos o número de átomos dos elementos.
Observe que, se colocarmos o mesmo coeficiente junto à fórmula da água, teremos a mesma quantidade de átomos dos dois lados.
Portanto, a equação química corretamente balanceada é:
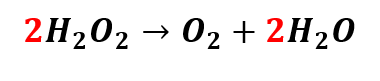
(Disponível em: Toda Matéria . Acesso em: 28 de junho de 2021).
4) (UFMG) A equação Ca(OH)_2+H_3 PO_4→Ca_3 (PO_4 )_2+H_2 O não está balanceada. Balanceando-a com os menores números possíveis, a soma dos coeficientes estequiométricos será:
a) 4
b) 7
c) 10
d) 11
e) 12
Resposta: E.
Resolução:
Utilizando o método das tentativas, a ordem de balanceamento será:
1º passo: Como o elemento que aparece apenas uma vez em cada membro e tem maior índice é o cálcio, iniciamos o balanceamento por ele.
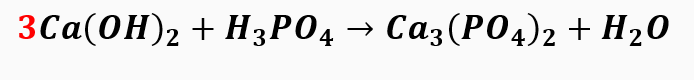
2º passo: Seguimos o balanceamento pelo radical PO4, que também só aparece uma vez.
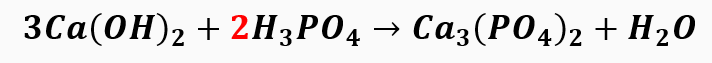
3º passo: balanceamos o hidrogênio.
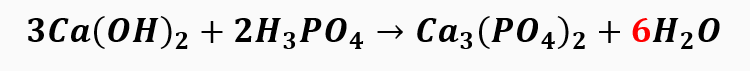
Com isso, observamos que automaticamente a quantidade de oxigênio foi ajustada e o balanceamento da equação é:
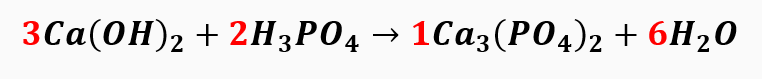
Lembrando que quando o coeficiente é 1 não precisa escrevê-lo na equação. Somando os coeficientes, temos:
3+2+1+6=12
(Disponível em: Toda Matéria . Acesso em: 28 de junho de 2021).
Roteiro de estudos elaborado pelo Professor Elves Silva Moreira