Conteúdos
– Partículas subatômicas: prótons, elétrons e neutrons
– Regiões atômicas: núcleo e eletrosfera
– Átomos neutros e íons
Objetivos
– Reconhecer as partículas subatômicas
– Reconhecer as características do modelo atômico de Rutherford-Bohr
– Diferenciar os elementos químicos a partir de sua configuração atômica
– Diferenciar átomo neutro e íons (cátions e ânions)
1ª Etapa: Início de conversa
A química é uma ciência cujo objeto de estudo são os materiais e as substâncias. É possível estudá-la em três perspectivas: constituição, propriedades e transformação. Esses estudos podem ser feitos em três níveis de representação: macroscópico, submicroscópico e simbólico. Como o tema dessa aula envolve a ideia de modelos atômicos, o estudo da química será pautado em uma perspectiva submicroscópica e representacional.
Como revisão dos conteúdos de modelos atômicos, poderá ser utilizado o vídeo “Tudo se transforma, história da química, história dos modelos atômicos”, da CCEAD-PUC-Rio. Nesse vídeo, é possível acompanhar a evolução de diferentes modelos para o átomo e introduzir a proposta da aula.
2ª Etapa: Objeto Virtual de Aprendizagem
Na segunda etapa, os alunos utilizarão o Objeto Virtual de Aprendizagem (OVA). Confira o site Monte um átomo, elaborado pela PhET Interactive Simulations. Esse OVA possui três modalidades: construir átomo, símbolo e jogo. (FIGURA 1)

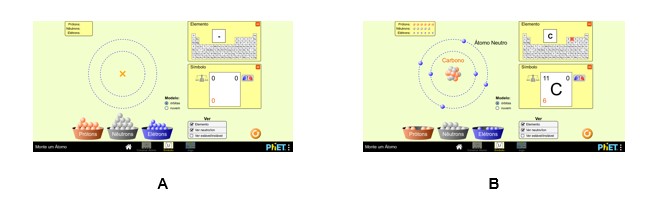
Na modalidade Construir átomo, a tela inicial (Figura 2A) mostra as subdivisões do átomo de Bohr. O aluno deve movimentar as partículas subatômicas para as diferentes regiões de forma apropriada, isto é, prótons e nêutrons para o núcleo e os elétrons para a eletrosfera. A medida que se executa tal processo, no lado direito da tela, será mostrado o elemento químico que aquele átomo montado corresponde, assim como a carga resultante e o número de massa. Na Figura 2B, apresenta-se um exemplo para o átomo de carbono.

Na modalidade Símbolo (Figura 3), as funcionalidades são as mesmas, a diferença é que no lado direito da tela será mostrado a simbologia do elemento químico construído, incluindo as informações de número atômico, número de massa e carga resultante. Na Figura 3B, apresenta-se um exemplo para o átomo de Carbono.
3ª Etapa: Os jogos do OVA
Na terceira etapa da aula, o (a) professor (a) poderá usar a função Jogo (Figura 4). O Quadro 1 apresenta uma descrição dos quatro tipos de jogos existentes nesse OVA.
(Confira a tabela Descrição dos quatro tipos de jogos do OVA no arquivo anexo)
4ª Etapa: Finalizando a discussão
Para finalizar a aula, o (a) professor (a) poderá fazer alguns exercícios com os alunos. Seguem algumas sugestões com os respectivos gabaritos.
1. (Unifor – CE) Dentre as espécies químicas:
5B9 5B10 5B11 6C10 6C12 6C14
as que representam átomos cujos núcleos possuem 6 nêutrons são:
a) 6C10 6C12
b) 5B11 6C12
c) 5B10 5B11
d) 5B9 6C14
e) 5B10 6C14
Resposta correta: B
2. (UCS-RS) O conhecimento das partículas subatômicas, bem como do seu número, é útil para a compreensão das propriedades individuais dos átomos. Os átomos distinguem-se uns dos outros pelo número de prótons e de nêutrons que contêm. Com relação ao átomo de boro (5B11), é correto afirmar que ele distingue dos demais átomos por possuir…
a) 5 prótons e 6 nêutrons.
b) o número atômico e o número de nêutrons iguais a 6.
c) o número atômico e o número de nêutrons iguais a 5.
d) número igual de prótons e nêutrons.
e) 11 prótons e 5 nêutrons.
Resposta correta: A
3. (Mack-SP) O número de protons, de elétrons e de nêutrons do átomo 17Cl35 é, respectivamente:
a) 17, 35, 35
b) 35, 17, 18
c) 17, 18, 18
d) 17, 17, 18
e) 52, 35, 17
Resposta correta: D
Materiais Relacionados
Recomenda-se que o/a professor/a acesse algum material preliminar para conhecer um pouco mais sobre experimentação no ensino de química e estrutura atômica:
1 – Leia o texto “Descaminhos rumo à aprendizagem significativa”.
2 – Estude o artigo “A natureza pedagógica da experimentação: uma pesquisa na licenciatura em química”.
3 – Explore os conceitos do texto “Dificuldades de ensino e aprendizagem dos modelos atômicos em química”.

