Conteúdos
– Rapidez de reação química
– Superfície de contato e reação química
– Temperatura e reação química
– Concentração e reação química
Objetivos
– Introduzir o estudo da cinética química
– Identificar os fatores que alteram a velocidade de reação
1ª Etapa: Início de conversa
Os materiais e as substâncias são os objetos da ciência chamada química e o seu estudo pode ser feito em três perspectivas: constituição, propriedades e transformação. Pensando no aspecto da transformação, a cinética química é a área que estuda as velocidades das reações químicas e os fatores utilizados para o seu controle. O objetivo desse plano de aula é apresentar ao estudante os fatores que promovem alterações na velocidade das reações químicas.
2ª Etapa: O objeto virtual de aprendizagem - cinética química
Na segunda etapa, os alunos utilizarão o Objeto Virtual de Aprendizagem (OVA) Reações Químicas – Cinética Química. (FIGURA 1)1.

Figura 1. Tela inicial do OVA Reações Químicas – Cinética Química
1 Prezado(a) professor(a), caso tenha dificuldade em abrir o OVA, utilize outro navegador. Caso os problemas persistam, siga a seguinte orientação do site Wikihow.
Após apertar o play, um cientista chamado Prof. Xavier irá explicar o objetivo dos experimentos que serão realizados pelo OVA (Figura 2).
A

B

Figura 2. O laboratório virtual: A – Apresentação do Prof. Xavier; B – descrição de Cinética Química.
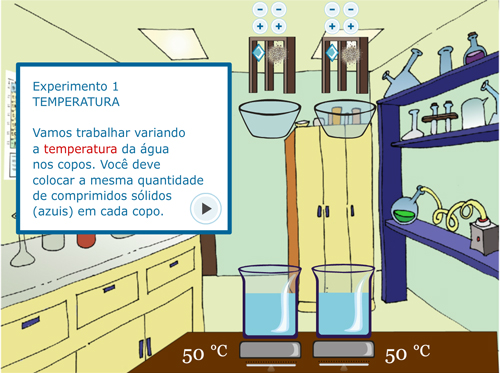
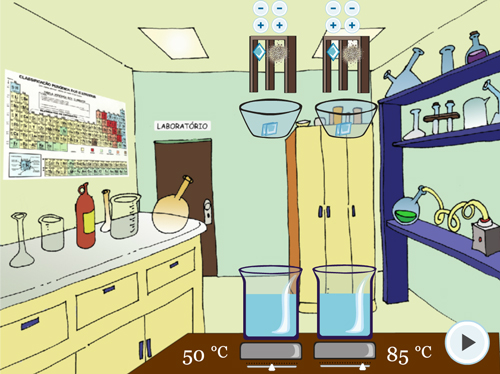
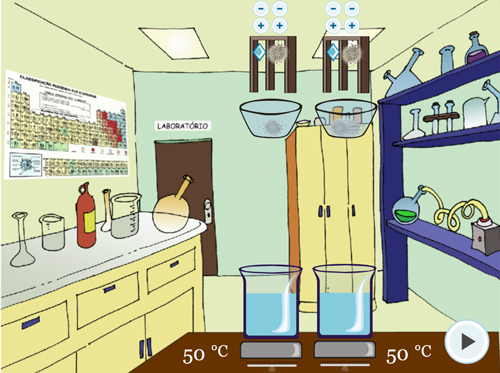
Após a descrição, será iniciado o Experimento 1 – Temperatura. A primeira parte é a orientação do experimento (Figura 3A). Na Figura 3B, pode-se observar que o tipo de sólido (pastilhas) e a quantidade (duas) são as mesmas para cada béquer, alterando a temperatura: 50 ºC para um béquer e 85ºC para o outro béquer.
A
B
C
D

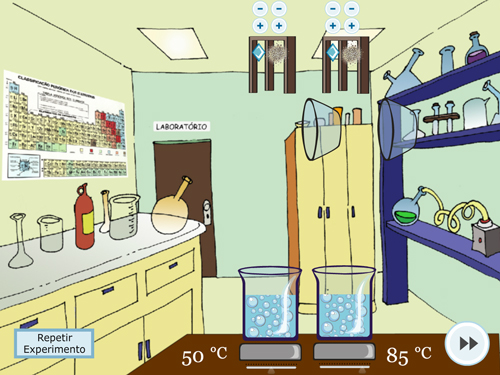
Figura 3. Experimento 1 – Efeito da Temperatura: A – Orientação do procedimento; B – Realização do experimento em temperaturas diferentes, mantendo as outras variáveis iguais; C – Visualização da borbulha; D – Questão sobre o experimento.
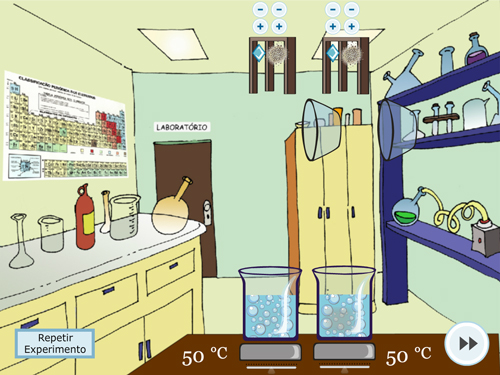
Após apertar o play, os sólidos serão jogados no béquer e iniciará o processo de borbulha (FIGURA 3C). No simulador será possível observar que o experimento com maior temperatura terá maior rapidez de borbulha, indicando assim, maior rapidez de reação. O experimento pode ser repetido diversas vezes, alterando as quantidades, os tipos de sólidos (desde que se mantenha o mesmo para os dois béqueres) e a temperatura (sendo obrigatoriamente diferente em cada béquer). Ao final será apresentado uma pergunta para reflexão do estudante sobre o que realizou (FIGURA 3D).
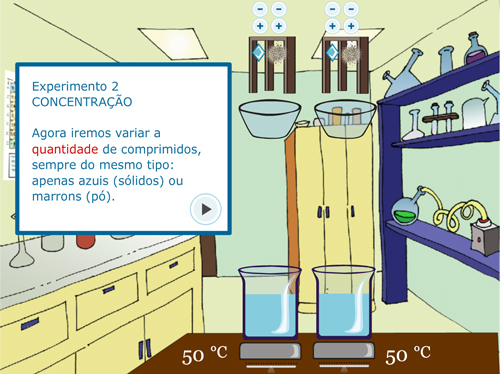
A primeira tela do Experimento 2 – Concentração é a orientação do experimento (Figura 4A). Na Figura 4B, pode-se observar que o tipo de sólido e a temperatura são as mesmas para ambos os béqueres, alterando apenas a quantidade do soluto.
A
B
C
D

Figura 4. Experimento 2 – Efeito da Concentração: A – Orientação do procedimento; B – Adição de quantidades diferentes de sólido, mantendo as outras variáveis iguais; C – Visualização de borbulha; D – Questão sobre o experimento.
Em seguida, os sólidos serão jogados no béquer e iniciará o processo de borbulha (FIGURA 4C). No simulador será possível observar que o béquer com maior concentração terá maior rapidez de borbulha, indicando assim, maior rapidez de reação. Ao final será apresentado uma pergunta para reflexão do estudante sobre o que realizou (FIGURA 4D).
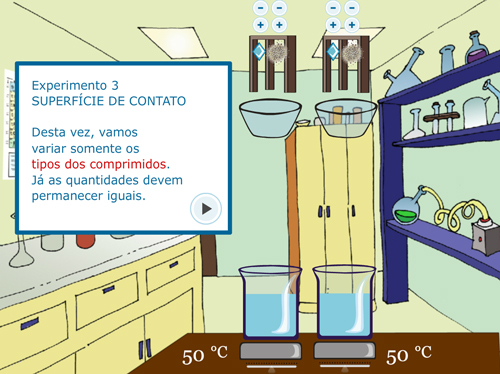
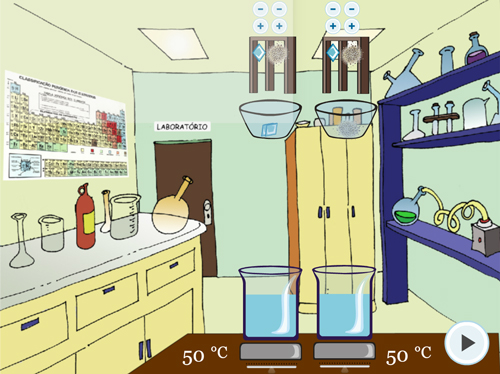
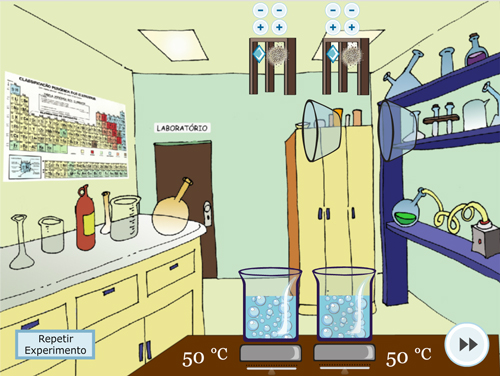
Para o Experimento 3 – Superfície de Contato, o procedimento dos experimentos anteriores se repete, alterando em cada béquer o tipo de sólido (em um pastilha e no outro pó) mas mantendo-se iguais as quantidades de sólido e a temperatura (FIGURA 5).
A
B
C
D
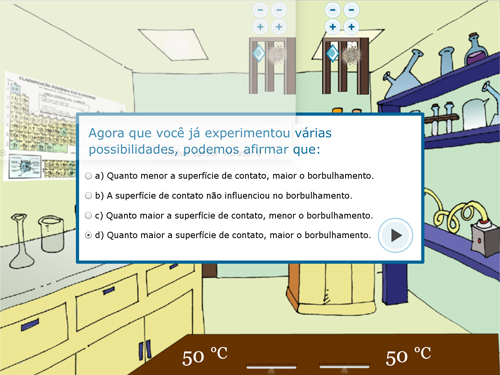
Figura 5. Experimento 3 – Efeito da Superfície de Contato: A – Orientação do procedimento; B – Adição de tipos diferentes de sólido, mantendo as outras variáveis iguais; C – Visualização de borbulha; D – Questão sobre o experimento.
3ª Etapa: Finalizando a discussão
Para finalizar a aula, o(a) professor(a) poderá fazer alguns exercícios com os alunos. Seguem algumas sugestões com as respectivas respostas.
1. (Udesc-SC) A cinética química é a área da química que trata das velocidades das reações.
Analise os processos em relação à cinética química.
I. Quando o carvão está iniciando a sua queima, as pessoas ventilam o sistema para que a queima se propague mais rapidamente.
II. Um comprimido efervescente se dissolve mais rapidamente quando triturado.
Assinale a alternativa que contém os fatores que influenciam as velocidades das reações químicas nos processos descritos em I e II, respectivamente.
a) concentração, superfície de contato.
b) catalisador, concentração.
c) temperatura, concentração.
d) superfície de contato, catalisador.
e) temperatura, catalisador.
Resposta correta: A
2. (PUC-RS / Adaptado) Relacione os fenômenos descritos na coluna I com os fatores que influenciam sua velocidade mencionados na coluna II.
Coluna I
1 – Queimadas alastrando-se rapidamente quando está ventando;
2 – Conservação dos alimentos no refrigerador;
3 – Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
Coluna II
A – superfície de contato;
B – concentração;
C – temperatura.
A alternativa que contém a associação correta entre as duas colunas é
a) 1 – B; 2 – A; 3 – C.
b) 1 – C; 2 – B; 3 – A.
c) 1 – A; 2 – B; 3 – C.
d) 1 – B; 2 – C; 3 – A.
e) 1 – C; 2 – A; 3 – B.
Resposta correta: D
3. (Mack-SP) Um aluno, querendo verificar os conceitos de cinética química discutidos na escola, dirigiu-se a uma drogaria e comprou alguns comprimidos efervescentes, os quais continham, de acordo com o rótulo do produto, massas iguais de bicarbonato de sódio. Ao chegar a sua casa realizou a mistura desses comprimidos com água usando diferentes métodos. Após a observação do fenômeno de liberação gasosa, até que toda a massa de cada comprimido tivesse sido dissolvida em água, o aluno elaborou a seguinte tabela:
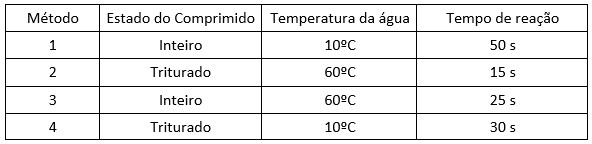
De acordo com os resultados obtidos e mostrados na tabela acima, o aluno fez as seguintes afirmações:
I. Ao comparar somente os métodos 1 e 2 fica impossível determinar qual dos dois fatores variados (estado do comprimido e temperatura da água), aumentou mais a velocidade da reação.
II. A mudança da condição da água, de fria para quente, faz com que, qualquer que seja o estado do comprimido, a velocidade da reação caia pela metade.
III. A influência da temperatura da água é maior do que a influência do estado do comprimido, no aumento da velocidade da reação.
Das afirmações acima, é correto dizer que o aluno errou:
a) apenas na afirmação I.
b) apenas na afirmação II.
c) apenas na afirmação III.
d) apenas nas afirmações II e III.
e) em todas as afirmações.
Resposta correta: B
Materiais Relacionados
Recomenda-se que o(a) professor(a) acesse algum material preliminar para conhecer um pouco mais sobre cinética química e velocidade de reações:
1 – “A Contextualização no ensino de cinética química”. Acesso em 24 de junho de 2018.
2 – “Modelos Didáticos e Cinética Química”. Acesso em 24 de junho de 2018.
3 – “Concepções sobre Cinética Química: a influência da Temperatura e da Superfície de Contato”. Acesso em 24 de junho de 2018.

