Conteúdos
Este roteiro de estudos de química trata das reações de oxirredução (redox) e como elas estão presentes em diversos processos naturais e industriais.
Objetivos
- Compreender os conceitos de oxidação e redução; e
- Identificar os agentes oxidantes e redutores em uma reação química.
Conteúdos / Objetos do conhecimento:
- Conceitos de oxidação e redução;
- Noção de número de oxidação (NOX); e
- Identificação de agentes oxidantes e redutores.
Palavras-chave:
Reação redox. Oxidação. Redução. Agente oxidante. Agente redutor. Eletroquímica. Corrosão. Baterias.
Proposta de estudo:
Este material tem o objetivo de apoiar os alunos na compreensão das reações redox e de suas principais aplicações.
1ª Etapa: Pergunta orientadora: o que são reações redox?
Reações redox (ou reações de oxirredução) são reações químicas que envolvem a transferência de elétrons entre substâncias. Elas ocorrem com a variação do número de oxidação (Nox) dos elementos envolvidos e são fundamentais em muitos processos químicos e biológicos.
As reações redox possuem alguns componentes, sendo eles:
- Oxidação – Perda de elétrons, aumento do número de oxidação.
- Exemplo: Fe → Fe²⁺ + 2e⁻ (o ferro perde elétrons e se oxida).
- Redução – Ganho de elétrons, diminuição do número de oxidação.
- Exemplo: Cu²⁺ + 2e⁻ → Cu (o cobre ganha elétrons e se reduz).
- Agente redutor – A substância que doa elétrons e se oxida.
- Agente oxidante – A substância que recebe elétrons e se reduz.
Sugestões de leitura:
- Reações de oxidação-redução (redox) (artigo). Oxirredução: o que é, como ocorre, tipos, resumo – Brasil Escola
- Reações de oxirredução: o que são, exemplos e exercícios – Toda Matéria
A partir da leitura do texto acima, responda às seguintes perguntas:
1) O que diferencia uma reação de oxidação de uma reação de redução?
2) Como identificar o agente oxidante e o agente redutor em uma reação química?
3) Cite exemplos de processos do cotidiano que envolvem reações redox.
4) Explique como ocorre a corrosão do ferro e como ela pode ser evitada.
Para saber mais, assista:
QUÍMICA COM PROF. PAULO VALIM. 9. NOX, Reações de Oxirredução e Introdução ao Balanceamento das Equações Químicas [Química Geral].
PROFESSOR GABRIEL CABRAL. BALANCEAMENTO POR OXIRREDUÇÃO – PASSO A PASSO.
Gabarito
1) A oxidação é o processo no qual uma substância perde elétrons, enquanto a redução é o processo no qual uma substância ganha elétrons. Essas duas reações sempre ocorrem simultaneamente, pois os elétrons perdidos por uma substância são ganhos por outra.
2) O agente oxidante é a substância que recebe elétrons e, portanto, sofre redução. O agente redutor é a substância que cede elétrons e, portanto, sofre oxidação.
3) Ferrugem: Oxidação do ferro na presença de oxigênio e umidade.
Combustão: Queima de combustíveis, como gasolina e etanol.
Fotossíntese: O CO₂ é reduzido a glicose e a água é oxidada a oxigênio.
4) A corrosão do ferro (ferrugem) ocorre devido à reação do ferro (Fe) com oxigênio (O₂) e água (H₂O), formando hidróxidos que depois se transformam em óxido de ferro hidratado, que é a ferrugem.
2ª Etapa: Cheque seus conhecimentos
Para iniciar esta etapa, revise os conhecimentos teóricos adquiridos sobre as reações redox. Nesta etapa, veremos como calcular essas reações:
1) Determine o número de oxidação (NOX) do enxofre (S) na substância H2SO4H (ácido sulfúrico).
2) Na reação abaixo, determine quem é o agente oxidante e quem é o agente redutor.
![]()
3) Calcule o número de oxidação do ferro no composto óxido de ferro III.
4) Qual é o número de oxidação do cromo no composto dicromato de potássio?
5) Identifique o agente oxidante e o agente redutor na reação:
![]()
Gabarito
1) Para resolver essa questão é necessário, primeiramente, considerar as regras de NOX. Depois disso, aplica-se a representação matemática.
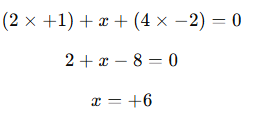
Resposta: o número de oxidação do enxofre (S) no ácido sulfúrico é +6.
2) Primeiramente, vamos identificar os NOX dos elementos, depois vemos as oxidações e as reduções.
O zinco passa de 0 para +2, ou seja, perdeu elétrons – oxidação
O cobre passa de +2 para 0, ou seja, ganhou elétrons – redução
Para identificarmos o agente oxidante, devemos ver quem sofreu redução (ganhou elétrons). Nesse caso, o cobre é o agente oxidante e o zinco é o agente redutor.
3) O oxigênio (O) normalmente tem NOX -2, utilizaremos a fórmula do óxido de Ferro III, e então a soma dos NOX deve ser zero:
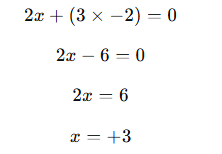
Resposta: O ferro no óxido de ferro III tem NOX +3.
4) Primeiro identificamos o número de oxidação do cromo no dicromato de potássio:
Potássio (K): NOX+1
Oxigênio (O): NOX -2
Vamos descobrir o NOX do cromo (Cr), e para isso o chamaremos de x:
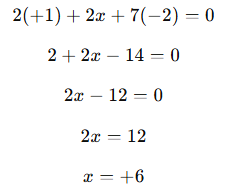
Resposta: O cromo no dicromato de potássio tem NOX +6.
5) Primeiramente, devemos atribuir os números de oxidação (NOX) e depois disso identificar as oxidações e reduções.
O ferro passa de 0 para +3, ou seja, perde elétrons – oxidação
O oxigênio passa de 0 para -2, ou seja, ganha elétrons – redução
O agente oxidante sofre redução (ganha elétrons), neste caso, o oxigênio.
O agente redutor é quem sofre oxidação (perde elétrons), neste caso, o ferro.
Bons estudos!
Roteiro de estudos elaborado pela Prof. Gabriela Ribeiro do Prado.
Revisão textual: Professora Daniela Leite Nunes.
Coordenação Pedagógica: Prof.ª Dr.ª Aline Monge.
Crédito da imagem: pixhook – Getty Images




