Conteúdos
● Variáveis de estado dos gases;
● Transformação isobárica;
● Transformação isotérmica;
● Transformação isovolumétrica.
Objetivos
● Compreender quais são as variáveis de estado envolvidas em uma transformação gasosa;
● Compreender o que é uma transformação isobárica;
● Compreender o que é uma transformação isotérmica;
● Compreender o que é uma transformação isovolumétrica.
Palavras-Chave:
Variáveis de estado dos gases. Transformações gasosas. Transformação isobárica. Transformação isotérmica. Transformação isovolumétrica.
Proposta de Trabalho:
O objetivo deste roteiro é auxiliar nos estudos em casa ou em outro ambiente. Nesse sentido, apresenta um percurso com textos base e algumas propostas de atividades, e, no final, há outros textos e vídeos que podem ajudar a compreender melhor o tema em questão.
Não é necessário fazer todas as etapas, ler todos os textos, ou assistir todos os vídeos, mas as questões norteadoras, bem como as subquestões que advém delas, ajudam na captação do conteúdo inteiro e dos principais conceitos.
Leia os textos propostos buscando as respostas para cada uma das perguntas. Se aparecerem mais dúvidas ao longo da leitura, aproveite para fazer anotações em seu caderno e aumentar sua pesquisa. Após as leituras de cada um dos textos, escreva um parágrafo resumindo seu aprendizado.
1ª Etapa: Variáveis de estado dos gases
Pergunta norteadora:
Quais são as variáveis de estado dos gases?
Texto: Estudo dos gases
Toda Matéria – Rosimar Gouveia
A partir da leitura do texto acima, responda às seguintes perguntas:
1) O que compõe um gás?
2) Quais são as variáveis de estado de um gás?
3) Complete a frase:
“Os gases não possuem forma ………………. e ocupam todo ………………. onde estão contidos. Além disso, podem ser comprimidos.”
4) Como podemos definir a pressão de um gás?
5) O grau de agitação das moléculas de um gás representa qual variável de estado?
6) O que é um gás ideal?
Para saber mais, assista:
Física – Aula de Gases Ideais: Variáveis de estado
2ª Etapa: Transformação isobárica
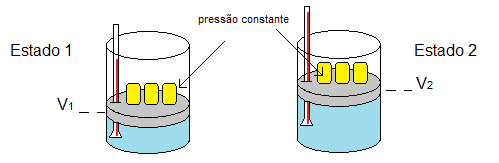
Para uma transformação isobárica, pode-se utilizar a Lei de Charles Gay-Lussac:

Pergunta norteadora:
O que é uma transformação isobárica?
Texto: Transformação isobárica
InfoEscola – Carla Reis Evangelista
A partir da leitura do texto acima, responda às seguintes perguntas:
1) Em uma transformação isobárica, qual é a grandeza física que se mantém constante?
2) Em uma transformação isobárica, o volume é diretamente proporcional a qual grandeza física?
3) Como podemos calcular o trabalho em um processo isobárico a partir do gráfico Volume x Pressão (V x P)?
Para saber mais, assista:
Transformação isobárica – Brasil Escola
3ª Etapa: Transformação isotérmica
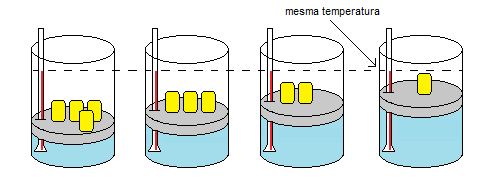
Para uma transformação isotérmica, pode-se utilizar a Lei de Boyle:

Pergunta norteadora:
O que é uma transformação isotérmica?
Texto: Transformação isotérmica
InfoEscola – Carla Reis Evangelista
A partir da leitura do texto acima, responda às seguintes perguntas:
1) Em uma transformação isotérmica, qual é a grandeza física que se mantém constante?
2) Em uma transformação isotérmica, quando a pressão diminui, o que acontece com o volume?
3) No Diagrama PV, qual é a figura que representa as transformações isotérmicas: uma reta, ou uma hipérbole?
Para saber mais, assista:
Transformação isotérmica – Brasil Escola
4ª Etapa: Transformação isovolumétrica ou isocórica
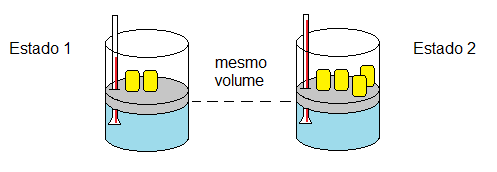
Para uma transformação isovolumétrica, pode-se utilizar a Lei de Charles:

Pergunta norteadora:
O que é uma transformação isovolumétrica?
Texto: Transformação isovolumétrica
InfoEscola – Carla Reis Evangelista
A partir da leitura do texto acima, responda às seguintes perguntas:
1) Em uma transformação isovolumétrica, qual é a grandeza física que se mantém constante?
2) Quais são os outros termos que podemos utilizar para caracterizar uma transformação isovolumétrica?
3) Existe realização de trabalho em uma transformação isovolumétrica?
Para saber mais, assista:
Transformação isocórica – Brasil Escola
5ª Etapa: Cheque seus conhecimentos
Realizar questões de vestibular e do ENEM é um excelente exercício durante estudo autodirigido, isso porque essas questões são seguidas de gabarito, mesmo quando são dissertativas. Abaixo, alguns exemplos de questões sobre o tema estudado:
1) (OSEC-SP) Um carro-tanque transportou gás cloro para uma estação de tratamento de água. Sabe-se que o volume do tanque que continha gás cloro era de 30 m3, que a temperatura era mantida a 20oC para a pressão ser de 2 atm e que, na estação de tratamento de água, esse cloro foi transferido para um reservatório de 50 m3 mantido a 293 K. Ao passar do carro-tanque para o reservatório, o gás sofreu uma transformação……..e a pressão do reservatório era………….
As lacunas são completamente preenchidas, respectivamente, com os dados:
a) isotérmica, 1,2 atm.
b) isométrica, 117 atm.
c) isobárica, 2 atm.
d) isocórica, 2 atm.
e) isovolumétrica, 1,2 atm.
Resposta: A
Justificativa:
Os dados fornecidos pelo exercício são:
→ Temperatura inicial (T1) = 20oC
OBS.: Em exercícios de transformações gasosas, a temperatura deve ser sempre trabalhada na unidade Kelvin. Para tal, basta somar a temperatura em graus Celsius com 273. No caso desta questão, a temperatura T1 é de 293 K.
– Pressão inicial (P1) = 2 atm
– Volume inicial (V1) = 30 m3
– Volume final (V2) = 50 m3
– Pressão final (P2) = ?
– Temperatura final (T2) = 293 K
Como a temperatura não sofreu alteração, temos uma transformação isotérmica (aquela que ocorre quando a temperatura é constante). A fórmula que deve ser utilizada é:
P1.V1 = P2.V2
2.30 = P2.50
50P2 = 60
P2 = 60
50
P2 = 1,2 atm
Disponível em: Mundo Educação
Acesso em: 09 de novembro de 2020.
2) Antes de realizar uma viagem de carro, em um dia cuja temperatura era de 30oC, um senhor calibrou os pneus utilizando 3 atm de pressão. Quando chegou ao destino, depois de 5 horas de viagem, mediu novamente a pressão dos pneus e constatou 3,4 atm de pressão. Sabendo que a variação de volume dos pneus é desprezível, marque a alternativa que indica a temperatura em que se encontravam os pneus:
a) 70,4 oC
b) 115,2 oC
c) 125,1 oC
d) 121,5 oC
e) 152,1oC
Resposta: A
Justificativa: O enunciado diz que o volume dos pneus é desprezível, por isso temos uma transformação isovolumétrica (aquela em que não temos modificação do volume). Além disso, o enunciado fornece os seguintes dados:
→ Temperatura inicial (T1) = 30oC
OBS.: Em exercícios de transformações gasosas, a temperatura deve ser sempre trabalhada na unidade Kelvin. Para tal, basta somar a temperatura em graus Celsius com 273. No caso deste exercício, a temperatura T1 é de 303 K.
– Pressão inicial (P1) = 3 atm;
– Pressão final (P2) = 3,4 atm;
– Temperatura final (T2) = ?
Como temos uma transformação isovolumétrica, a fórmula que será utilizada para determinar o valor da temperatura final é:
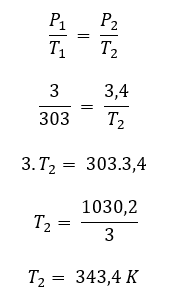
Como as respostas estão em graus Celsius, devemos subtrair o valor encontrado por 273 para encontrar o valor de T2.
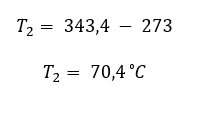
Disponível em: Mundo Educação
Acesso em: 09 de novembro de 2020.
3) Uma empresa pretende utilizar balões para realizar uma operação de publicidade em uma praia. Os balões foram preenchidos com uma pressão de 760 mmHg, a uma temperatura de 32 oC. Ao chegar à praia, a temperatura estava em 42oC, mas a pressão ainda era de 760 mmHg. Quantas vezes o volume dos balões foi alterado ao chegar à praia?
a) 1,3
b) 2,4
c) 3,01
d) 1,03
e) 0,331
Resposta: D
Justificativa:
Os dados fornecidos pelo exercício são:
→ Temperatura inicial (T1) = 32oC
OBS.: Em exercícios de transformações gasosas, a temperatura deve ser sempre trabalhada na unidade Kelvin. Para tal, basta somar a temperatura em graus Celsius com 273. No caso deste exercício, a temperatura T1 é de 305 K.
– Pressão inicial (P1) = 760 mmHg
– Volume inicial (V1) = x?
– Volume final (V2) = y?
– Pressão final (P2) = 760 mmHg
– Temperatura final (T2) = 42 oC
OBS.: Somando a temperatura em graus Celsius com 273, a temperatura T2 é de 315 K. Como a pressão não sofreu alteração, temos uma transformação isobárica (aquela que ocorre quando a pressão é constante). A fórmula que deve ser utilizada é:
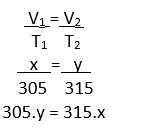
Obs.: Como o exercício questiona quantas vezes o volume dos balões foi alterado (final), devemos isolar o valor de y na fórmula:
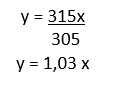
Disponível em: Mundo Educação
Acesso em: 09 de novembro de 2020).
4) Em um recipiente fechado, certa massa de gás ideal ocupa um volume de 12 litros a 293k. Se este gás for aquecido até 302k, sob pressão constante, seu volume será:
(a) 12,37 L
(b) 13,37 L
(c) 14,37 L
(d) 12 L
(e) 13 L
Resposta: A
Justificativa:
No estado inicial (1), o gás tem:
V1 = 12 L
T1 = 293 k
Depois de aquecido, estado 2:
T2 = 302 k
V2 = ?
O enunciado da questão dá uma informação muito importante, ele fala que o gás foi aquecido sob pressão constante, logo, trata-se de uma transformação isobárica e, dessa forma, para resolvermos o problema, basta aplicarmos a lei de Gay – Lussac:
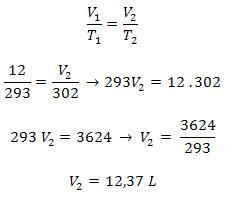
Disponível em: Brasil Escola
Acesso em: 09 de novembro de 2020.
5) (UFSC) O pneu de um automóvel foi regulado de forma a manter uma pressão interna de 21 libras-força por polegada quadrada, a uma temperatura de 14 ºC. Durante o movimento do automóvel, no entanto, a temperatura do pneu elevou-se a 55 ºC. Determine a pressão interna correspondente, em libras-força por polegada quadrada, desprezando a variação de volume do pneu.
Resposta:
No estado inicial, que agora identificaremos por 1, as variáveis de estado eram:
p1 = 21 libras-força por polegada quadrada
T1 = 14 ºC
No estado final, estado 2:
T2 = 55 ºC
p2 = ?
O exercício pede para calcular a pressão em libras-força por polegada quadrada depois do aumento da temperatura, assim vamos calcular p2. O enunciado do exercício pede para desprezarmos a variação de volume, assim fica evidente que se trata de um exercício envolvendo uma transformação isovolumétrica. Para resolvermos o exercício, basta aplicarmos a equação da transformação isovolumétrica, também conhecida como Lei de Charles. Antes de aplicarmos a Lei de Charles, devemos transformar a temperatura que está em ºC para kelvin (K), que é a escala de temperatura absoluta.
Transformando a temperatura de ºC para K:

Aplicando a Lei de Charles:
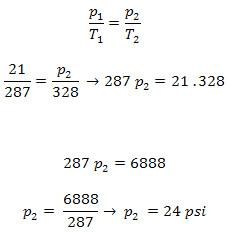
Disponível em: Brasil Escola
Acesso em: 09 de novembro de 2020.
6)
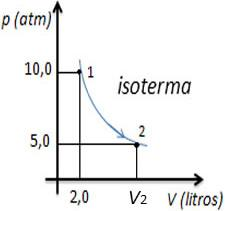
O gráfico acima mostra a isoterma de uma quantidade de gás que é levado de um estado 1 para um estado 2. O volume do estado 2, em litros, é:
(a) 2 L
(b) 4,5 L
(c) 6 L
(d) 4 L
(e) 3 L
Resposta: D
Justificativa:
No estado 1, temos:
P1 = 10 atm ;
V1 = 2,0 L
No estado 2:
P2 = 5 atm;
V2 = ?
Como temos o gráfico de uma isoterma, indica que o gás foi do estado 1 para o dois sem que houvesse uma variação de temperatura, assim sendo, trata-se de uma transformação isotérmica. Para resolvermos a questão, vamos aplicar a lei da transformação isotérmica, também conhecida como Lei de Boyle – Mariotte:
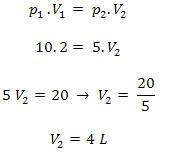
Disponível em: Brasil Escola
Acesso em: 09 de novembro de 2020.
Roteiro de estudos elaborado pelo Professor Elves Silva Moreira




